Комбинированный филлер – безопасная, пролонгированная и результативная терапевтическая коррекция с эффектом волюметрии и уплотнения кожи
Автор:
Кореневская Айя Яновна врач-косметолог, преподаватель РУДН, автор научных статей по косметологии, спикер кадавер курса
Спектр возможностей работы с Редексис включает в себя как волюметрическую коррекцию, так и работу в разведениях с целью уплотнения кожного лоскута и «лифтинг» эффекта.
В ракурсе современной эстетической медицины все чаще перед специалистами встает вопрос выбора, поскольку количество доступных инъекционных наполнителей растет с каждым днем. Данная ситуация, в свою очередь, заставляет задуматься о безопасности вводимого материала и долгосрочных последствиях. В данной статье рассмотрим аспекты безопасности и эффективности работы с тканевым наполнителем на основе стабилизированной гиалуроновой кислоты и декстраномера – Редексис (Prollenium, Канада).
Редексис относится к категории медленно резорбируемых дермальных филлеров и обладает уникальными свойствами благодаря составу (25 мг/мл стабилизированная ГК (высокого уровня очистки – уровень эндотоксина <0,025 EU/мл), 25 мг/мл положительно заряженный декстраномер). Декстран является продуктом бактериального (Leuconostoc mesenteroides) производства и синтезируется из сукрозы. По структуре декстран – гидрофильный полисахарид, состоящий из мономеров глюкозы, боковые цепи связаны между собой (1 - 2), (1 - 3) или (1 - 4), с молекулярной массой от 3,000 Да до 2,000,000 Да (рис.1)
Stephen J. Kennedy. Summary Report on Sephadex Biocompatibility and Biodegradability. Redexis® Dermal Fillers Report. 2012
Рис.1 Структура декстрана
Рис. 2 Структура гиалуроновой кислоты
Интересен тот факт, что для синтеза гиалуроновой кислоты необходимы компоненты полимера: глюкуроновая кислота и N-ацетилглюкозамин. Глюкуроновая кислота (рис. 2) синтезируется посредством ряда ферментативных реакций из глюкозо-6-фосфата. N-ацетилглюкозамин синтезируется из фруктозо-6-фосфата. Таким образом, можно предположить, что декстраномер (кроме своих волюметрических и коллагеностимулирующих свойств) по мере своей биодеградации предоставляет субстрат для синтеза гиалуроновой кислоты.
Ввиду своей биосовместимости продукты, содержащие декстран применяются в медицине со времен II мировой войны. Так, было отмечено, что раствор декстрана способен возмещать объем циркулирующей крови, перенаправляя интерстициальную жидкость в кровяное русло. Среди других сфер медицины, декстраны используются в офтальмологии, гинекологии, урологии и т.д. Таким образом, наиболее частыми индикациями для применения декстранов являются: растворы для сохранности органов для трансплантации, носитель для вакцин, компонент дермальных имплантов.
С точки зрения косметологии, сосредоточимся именно на последнем пункте и рассмотрим аспекты безопасности и практической значимости. В дермальном импланте Редексис декстраномер имеет размер 127 μm, что позволяет избежать фагоцитирования при введении геля, таким образом минимизировать воспалительную реакцию и пролонгировать нахождение в тканях. Вопрос поведения имплантируемых материалов с различным размером частиц уже изучался и представлен в публикациях. Одно из исследований сосредоточилось на нескольких размерах микросфер PMMA (4,3; 8,3; 20; 47,8; 72 μm). Микросферы были погружены в среду макрофагов, клеток Лангерганса, кератиноцитов. Ученые пришли к выводу, что микросферы диаметром более 20 μm не подвергались фагоцитозу ни одним из перечисленных видов клеток.
Vera B., Gottfried Lemperle, Richard L. Phagocytosis of Different Particulate Dermal Filler Substances by Human Macrophages and Skin Cells. Dermatologic Surgery 2002; 28: 484-490
Исследование Mustoe et al. на модели животных привело к более глубокому пониманию использования декстраномера в положительно заряженной модификации. Так, было выявлено, что, применяя положительно заряженный вариант декстрана заживление ран у крыс происходит гораздо быстрее относительно нейтральных или отрицательно заряженных частиц. Похожие результаты получили Burgess et.al. и Christoforou et.al. в моделях на обезьянах.
Mustoe T, Weber D, and Kurkowski M. Enhanced healing of cutaneous wounds in rats using beads with positively charged surfaces. Plastic and Reconstruct. Surg. 1992;89(5):891–897.
Burgess E, Hollinger J, Bennett S, Schmitt J, Buck D, Shannon R, Joh S, Choi J, Mustoe T, Lin X, Skalla W, Connors D, Christoforou C, and Gruskin E. Charged beads enhance cutaneous wound healing in rhesus non-human primates. Plastic & Reconstructive Surgery. 1998; 102(7):2395–2403.
C. Christoforou, X. Lin, S. Bennett, D. Connors, W. Skalla, T. Mustoe, J. Linehan, F. Arnold, and E. Gruskin. Biodegradable positively charged ion exchange beads: A novel biomaterial for enhancing soft tissue repair. Journal of Biomedical Materials Research Part A. 1998; 42(3):376–386.
Такие наблюдения сделали декстраномер прекрасным кандидатом в качестве биоматериала для дермального/ субдермального введения. Ряд работ Eppley et. al. был посвящен этой теме, имплантируя декстраномер с целью волюметрии подкожно крысам. В результате было обнаружено достаточное скопление коллагена в метах имплантации с минимальной воспалительной реакцией и отсутствием хронического воспаления.
Рис. 3 Биодеградация при воздействии энзимов в течение 8 дней: (a) физиологический раствор (b) декстраназа 5610 U/ мл (c) α-глюкозидаза 615 U/мл, (d) коллагеназа 10,000 U/мл, (e) гиалуронидаза 10,654 U/мл, (f) лизоцим 5,782,860 U/мл, 37, pH 7.4
Eppley B, Sidner R, Platis J, and Sadove A. Bioactivation of free-fat transfers: A potential new approach to improving graft survival. Plastic & Reconstructive Surgery.1992; 90(6):1022–1030.
Eppley B, Snyders R, Winkelmann T, and Delfino J. Autologous facial fat transplantation: Improved graft maintenance by microbead bioactivation. Journal of Oral and Maxillofacial Surgery.1992; 50(5):477–482
Eppley B, Summerlin D-J, Prevel C, and Sadove A. Effects of a positively charged biomaterial for dermal and subcutaneous augmentation. Aesthetic Plastic Surgery. 1994; 18(4):413–416. Eppley B, Summerlin D-J, and Sadove A. A potential biomaterial composite for dermal and subcutaneous augmentation. Ann Plast. Surg. 1994; 32(5):463–468.
Редексис принадлежит к филлерам пролонгированного действия и сохраняет объемные и коллагеностимулирующие функции на протяжении 12-18 месяцев. Stenberg et.al. предоставили данные о периоде биодеградации филлера на основе декстраномера. В исследование были включены 9 свиней и 34 крысы, которым был инъецирован филлер на основе декстраномера и гиалуроновой кислоты. В результате наблюдения объем введенного импланта сократился на 23% в течение 12 месяцев. По данным других специалистов отмечена редукция объема филлера на 20% через 12 месяцев, что соизмеримо с предыдущими данными.
Stenberg A, Larsson E, Lindholm A, Ronneus B, Stenberg A, Lackgren G (1999) Injectable dextranomer-based implant: histopathology, volume changes and DNA-analysis. Scand J Urol Nephrol. 1999; 33:355–361.
Elzayat, E.A., Karsenty, G., Bismar, T.A. et al. Volume changes and histological response to injected dextranomer/hyaluronic acid copolymer (Zuidex™) and collagen (Contigen®) in rats. Int Urogynecol J. 2008;19, 247–252.
Отмечено, что деградация декстраномера происходит путем гидролиза и с помощью ферментов, выделяемых фибробластами и макрофагами. В процесс вовлечены лизоцим, неспецифицеская эстераза, желатиназа, гиалуронидаза-1, α-глюкозидаза (рис. 3). Соизмеримые данные получены как в экспериментах на культуре клеток, так и при субдермальной имплантации in vivo.
Pan et.al. Hui Pan, Hongliang Jiang, and Weiliam Chen. The biodegradability of electrospun dextran/plga scaffold in a fibroblast/macrophage co-culture. Biomaterials. 2008;29:1583–1592.
Jung Bo Huh с коллегами в своей публикации сконцентрировались на гистологической картине, характерной для мягких тканей после введения подкожно изотонического хлорида натрия в качестве контроля, гиалуроновой кислоты и декстраномера. В группе контроля не было отмечено никаких изменений.
Рис. 4. Гистологическая картина образцов через 12 недель после введения физиологического раствора (A,B); гиалуроновой кислоты (C,D); декстраномера (E,F)
В группе гиалуроновой кислоты последовали изменения в виде незначительного количества макрофагов, узких пучков вновь сформированного коллагена, неоваскуляризации. Декстраны располагались в ткани в виде гомогенной субстанции, также было обнаружено небольшое скопление макрофагов и значительная инфильтрация фибробластами с формированием коллагена, отмечена умеренная неоваскуляризация (рис. 4). В качестве модели животных были выбраны 50 крыс.
Jung-Bo Huh. Effects of PMMA and Cross-Linked Dextran Filler for Soft Tissue Augmentation in Rats. Int. J. Mol. Sci. 2015; 16(12): 28523-28533.
В рутинной практике, прежде всего, Редексис является препаратом выбора, когда перед специалистом стоит задача значимого воссоздания объема с минимальной затратой препарата.
Такие свойства декстраномера (+ ГК) подчеркнуты во многих научных трудах. Интересные данные по волюметрической коррекции опубликованы в журнале андрологии. В проспективном мультицентровом исследовании приняли участие 20 мужчин, которые прошли процедуру аугментации glans penis в период с июня по август 2013 года. Было отмечено, что через 24 недели после инъекции площадь поверхности значительно увеличилась у всех мужчин (таб.1).
Таблица 1. Сравнение результатов между университетами при инъецировании декстрана
В среднем увеличение площади составило 68.7% ± 14.0% (P < 0.001). Институт, введенный объем геля (мл), площадь поверхности glans penis (до введения (см2), через 24 недели после введения (см2), разница между ДО и ПОСЛЕ (%))
Dae Yul Yang, Kyungtae Ko, Seong Ho Lee, Du Geon Moon, Jong Wook Kim, Won Ki Lee. Efficacy and safety of newly developed crosslinked dextran gel injection for glans penis augmentation with a novel technique. Asian J Androl. 2018; 20(1): 80–84.
Сравнительная работа в отношении клинических эффектов введения коллагена и декстраномера/гиалуроновой кислоты была выполнена в 2008 году. Всего 57 крыс было включено в наблюдение, где 9 животных представляли группу контроля, 24- группу инъекций коллагена, 24- группу инъекций филлера на основе декстраномера/гиалуроновой кислоты.
Подкожно в область передней брюшной стенки вводили 0,35 мл выбранного материала. Средние изменения объема импланта распределились следующим образом: 0.56±0.12, 0.43±0.08 и 0.28±0.02 мл в 1, 6 и 12-ый месяц, соответственно в группе декстраномер/ ГК. Средние изменения объема в группе коллагена: 0.25±0.03, 0.21±0.08 и 0.21±0.01 в 1, 6 и 12- ый месяц, соответственно (рис.5).
Рис. 5. Изменения объема импланта (мл) на основе декстраномера/ГК и коллагена в различные временные интервалы (1 месяц, P=0.0001, 6 месяцев, P= 0.0002, 12 месяцев, P=0.0023)
Важным наблюдением является то, что в обеих группах практически не было значимых различий в реакциях воспаления в тканях вокруг имплантируемых материалов. Через 1 и 6 месяцев интенсивность воспалительной реакции сопоставима, в то время как через 12 месяцев в группе коллагена воспалительный процесс более выражен (рис. 6).
Рис. 6. Показатели реакции воспаления на протяжении 12 месяцев в тканях, окружающих имплантируемый материал
Практическую значимость представляет также способность филлера минимально смещаться после установки в ткани. Так, согласно Stenberg и соавт. отмечено отсутствие миграции частиц декстраномера после введения в стенку мочевого пузыря кроликам.
Stenberg A.M., Sundin. Lack of distant migration after injection of a sup 125 iodine labeled dextranomer based implant into the rabbit bladder. Journal of Urology. 1997; 158 (5):1937-1941.
Последние данные о поведении филлера Редексис в мягких тканях человека получены в результате исследования, проведенного в России в 2020 году.
Специалисты провели комплексную морфологическую оценку состояния дермы после имплантации филлера ReDexis® у 10 пациенток. Во всех образцах кожи пациенток до имплантации филлера ReDexis® отмечены явления атрофии дермы, преимущественно среднего и глубокого слоев.
В биоптатах, взятых на вторые - седьмые сутки после имплантации филлера, отмечалась слабо выраженная воспалительная реакция: умеренный интерстициальный отек, гиперемия капилляров, мелкоочаговая полиморфноклеточная инфильтрация. В составе клеточного инфильтрата преобладали лимфоциты и плазматические клетки, с примесью единичных нейтрофильных и эозинофильных лейкоцитов.
При сравнении образцов, взятых до введения препарата и на 2-7 сутки после введения, кроме слабо выраженной воспа лительной реакции, отмечается очаговое усиление продукции коллагена субэпидермально и в верхнем отделе дермы. В большинстве образцов ткани, взятых через 1 месяц после имплантации филлера, отмечали сходные изменения: гиперпродукция коллагена в виде неравномерного утолщения волокон; затухание признаков воспалительной реакции.
В большинстве образцов, полученных через 3 месяца после имплантации филлера отмечали продолжающиеся процессы гиперпродукции коллагена в различных слоях дермы. У ряда пациенток процесс носил очаговый характер, у других – тотальный. К 6 месяцам после имплантации филлера наблюдается в большинстве случаев выраженное значимое увеличение толщины дермы за счет оформленной соединительной ткани с преобладанием волокон коллагена.
Микросферы декстраномера на этом этапе с признаками биорезорбции – фрагментированы по всему своему объему. Через 12 месяцев после имплантации филлера «удерживается состояние» утолщения дермы за счет оформленной соединительной ткани с хорошей васкуляризацией, преимущественно в среднем слое. Имеет место очаговая клеточная инфильтрация преимущественно фибробластами и единичными лимфоцитами в местах биорезорбирующихся микросфер декстраномера (рис. 7).
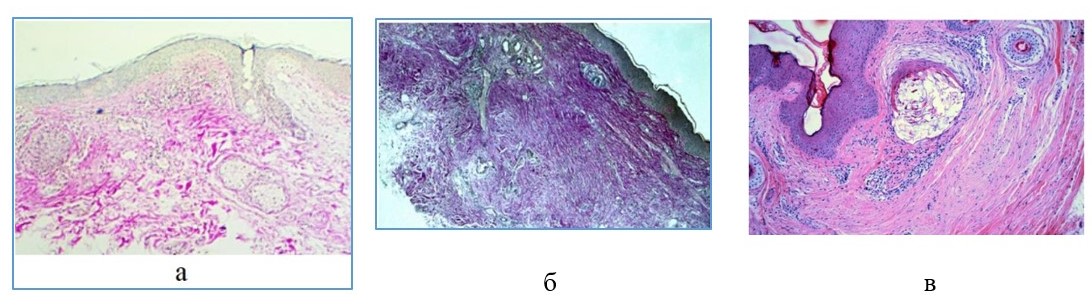
Рис. 7. Морфологические особенности кожи пациентки Б. в различные сроки после имплантации ReDexis®:
а – различная толщина и дезорганизация коллагеновых волокон в структуре дермы до имплантации филлера. Окраска пикрофуксином по Ван Гизон, х10;
б – уменьшение воспалительной реакции и гиперпродукция соединительной ткани во всех слоях дермы через 3 месяца после имплантации филлера. Окраска крезиловым фиолетовым, х10;
в – плотная оформленная соединительная ткань, равномерно выполняющая дерму с включениями фрагментированных микросфер декстраномера. Незначительная диффузноочаговая инфильтрация с преобладанием клеток лимфоидного ряда (6 месяцев). Окраска гематоксилином и эозином, х10
г – увеличение толщины дермы за счет равномерного заполнения всех слоев дермы плотной оформленной соединительной тканью (6 месяцев). Окраска PSR, х10;
д – преимущественно продольная ориентация коллагеновых фибрилл в составе оформленной соединительной ткани дермы (12 месяцев). Окраска PSR, х10.
Супильников А.А., Пономарева Ю.В. и соавт. Гистологическое исследование кожи после применения филлера Редексис: отчет. 2020:1-54
Таким образом, Редексис безопасен при введении, что доказано многими научными исследованиями. Более того, способность декстраномера формировать значительный объем, а также стимулировать коллагеногеногенез обуславливают применение филлера как в целях волюметрической коррекции (глубокое введение, без разведения), так и – уплотнения и перемещения мягких тканей (поверхностное введение, в разведении).
В практической деятельности Редексис незаменим в случае выраженной потери объема, а также для пациентов, у которых резорбция филлеров на основе стабилизированной ГК происходит быстрее ожидаемого срока в силу усиленного метаболизма или активного образа жизни. В этом случае целесообразно проводить инъекции неразведенного геля на уровень надкостницы/ глубоких жировых компартментов. Также волюметрический эффект может быть достигнут при векторном введении в высококонцентрированном виде (разведение 1:1). Данные методики могут сочетаться между собой в рамках одной процедуры, например, при коррекции средней трети лица, распределив 0,5 мл филлера в концентрированном виде и 0,5 мл – в разведении 1:1. Таким образом будет достигнут более «мягкий» объем (рис.8).

Рис. 8. Схема введения Редексис в болюсной и векторной технике
Еще один не менее эффективный диапазон работы с филлером Редексис- это введение материала субдермально в различных разведениях. Так, с целью уплотнения кожного лоскута, достижения «лифтинг» эффекта мы рекомендуем разведение 1:3-1:5 в зависимости от толщины кожи пациента. Данная техника позволяет проводить коррекцию как в области лица, так и тела (шея, декольте, кисти, передняя брюшная стенка и т.д.) (рис.9)

Рис. 9. Схемы введения Редексис в разведении в различных областях тела
Из вышеперечисленных данных зарубежных и отечественных работ, а также на основе нашего практического опыта, можно заключить, что филлер на основе гиалуроновой кислоты и декстраномера ReDexis® является безопасным, биосовместимым, длительным с точки зрения биорезорбции (более 12 месяцев) материалом, подходящим как для волюметрической коррекции, так и для коллагеностимуляции.
Купить ReDexis можно здесь
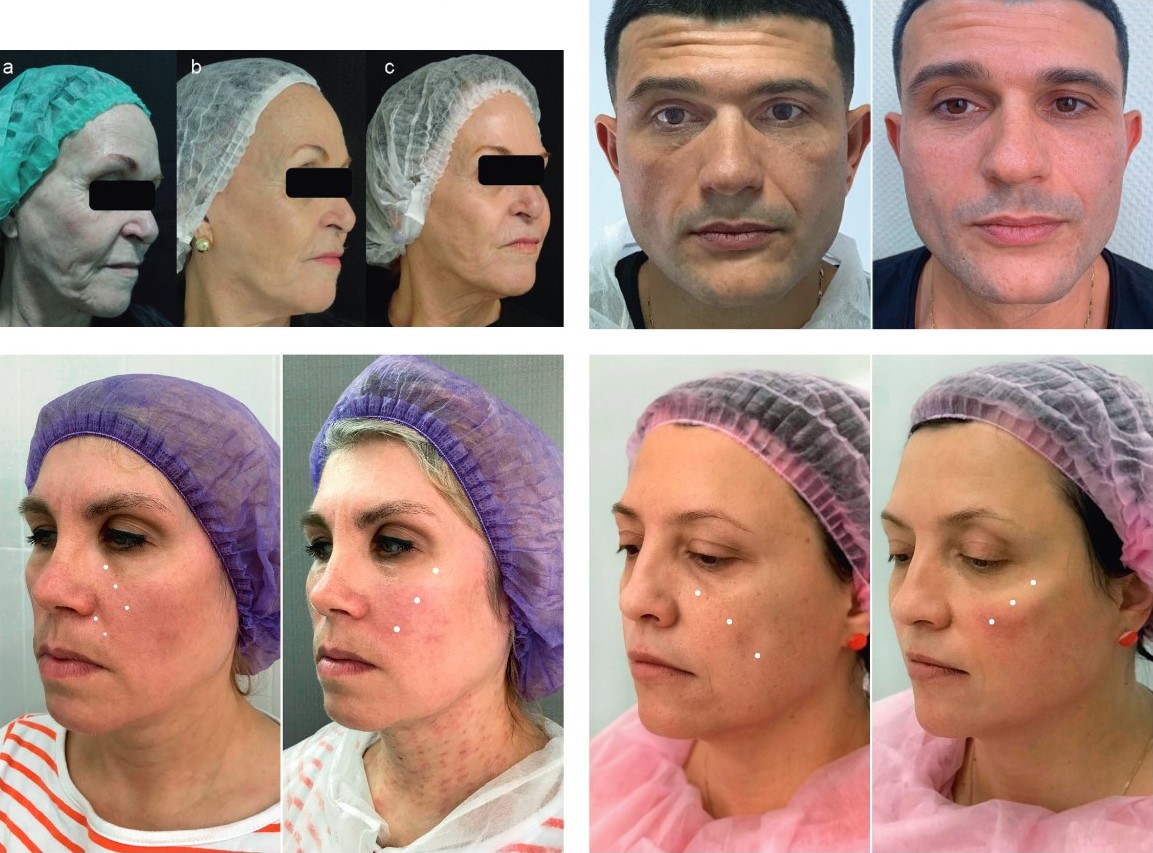
До и после применения препарата Redexis:
Восстановление объемов тканей средней трети лица и эффект лифтинга, устранение носогубных складок
прочитано
8075
раз